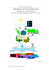Aufgabenblock I - TU Bergakademie Freiberg
Transcription
Aufgabenblock I - TU Bergakademie Freiberg
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
1
Gleichgewichtsreaktionen
1.1 Grundwasser - Lithosphäre
Aufgabe 1: Standard Brunnenanalyse
Für den Trinkwasserbrunnen ("B3") liegt folgende hydrogeochemische Analyse vor
(Konzentrationen in mg/L).
Temperatur = 22,3 °C
Ca = 75,0
HCO3- = 240,0
NO2- = 0,05
Li = 0,030
Fe = 0,067
Cd = 0,0004
Ba = 0,065
pH = 6,7
Mg = 40,0
SO42- = 200,0
PO43- = 0,60
B = 0,030
Ni = 0,026
As = 0,005
Pb = 0,009
pE = 6,9
K =3,0
Cl- =6,0
Si = 21,59
Al = 0,056
Cu = 0,078
Se = 0,006
U = 0,003
Na = 19,0
NO3- =1,5
F- = 1,30
Mn = 0,014
Zn = 0,168
Sr = 2,979
Modellgebiet:
Input:
Keywords sind TITLE, SOLUTION, END (auch zu finden im Keyword Index rechts),
unter dem Keyword SOLUTION wird die chem. Analyse definiert
Das Input-File und Hinweise zum Input-File finden Sie auf den nächsten Seiten.
Berechnung starten über Calculations/ Start bzw. das Icon „Calculate“
Im Progress Fenster wird der Stand der Berechnung angezeigt, am Ende erscheint DONE,
bzw. bei Problemen eine Fehlermeldung. Klickt man auf DONE öffnet sich automatisch das
Output Fenster.
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Output: (Standard-Output)
Reading data base
Datenbank Keywords werden eingelesen
Reading input data Eingabefile wird eingelesen
Beginning of initial solution calculations
solution composition (Konzentrationen in mol/L)
description of solution (Ionenstärke, Analysenfehler, pH, pe, etc.)
distribution of species (Speziesverteilung, Komplexbildung)
saturation indices (Über- / Untersättigung)
über Keyword Index per Mouseklick ist das Anwählen der einzelnen Unterpunkte möglich
Ablauf:
Öffnen Sie das Programm PHREEQC und laden/schreiben Sie die Brunnenanalyse in das
Input-Fenster. Speichern Sie dann das File als Aufg_1.phrq ab. Bevor Sie mit der
Berechnung starten, klicken Sie unter Calculations auf Files und laden Sie die Datenbank
WATEQ4F.DAT. Setzen Sie bei Default ein Häkchen und Klicken auf OK.
Starten Sie nun die Berechnung indem Sie auf Calculate klicken.
a) Bewerten Sie die Wasseranalyse hinsichtlich Analysefehler, Gesamtmineralisation,
auffälliger Elemente in Bezug auf Grenzwerte der TVO und redoxsensitiver Elemente.
b) Welche Elemente fallen aus der Reihe und warum?
c) Stellen Sie die Speziesverteilung der Ca, Mg, Pb und Zn-Spezies in Form von
Tortendiagrammen dar (in Excel!) Was fällt auf? In welcher Form liegen sie überwiegend
vor?
d) Zeigen Sie anhand eines Säulendiagramms alle übersättigten Fe-Mineralphasen auf.
TITLE Aufgabe 1: Standart Brunnenanalyse
SOLUTION 1
units ppm
temp 22.3
pH
6.7
pe
6.9
# Eh = 408.28 mV = 0.40828 V --> pE = 16.9*Eh
Ca
Mg
K
Na
75.0
40.0
3.0
19.0
Alkalinity
S(6)
Cl
N(5)
N(+3)
P
Si
F
Li
240.0 as HCO3
200.0 as SO4
6.0
1.5
as NO3
0.13 as NO2
0.60 as PO4
21.59 as SIO2
1.30
0.030072
# Konz in mg/L as [Komplexform]
# Ion[Wertigkeit] Konz in mg/L as [Komplexform]
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
B
Al
Mn
Fe
Ni
Cu
Zn
Cd
As
Se
Sr
Ba
Pb
U
END
0.029996
0.856007
1.378289
0.368479
0.026357
0.077515
0.167657
0.000471
0.009894
0.025665
2.979423
0.064659
0.008606
0.002747
(Hinweis:
Umrechnung der Konzentrationen im Output mol/L mg/L
Vergleich mit TW-Grenzwerten: Gesamtgehalte der Spezies verwenden da bei
analytischer Bestimmung z.B. von Sulfat alle S(6) zusammen als Sulfat bestimmt werden
Redoxsensitive Spezies = Spezies, die in verschiedenen Redoxstufen vorkommen (z.B As,
Fe, Cu, Mn, U)
Eh bei pH 7-8:
400 … 800 mV oxidierende Verhältnisse (pe ≈ 6.8 … 13.5)
0 … 400 mV teilreduzierende Verhältnisse
0 … - 400 mV reduzierende Verhältnisse
pe ≈ 16.9 * Eh
Komplexe nullwertige Komplexe erhöhte Mobilität
Speziesverteilung – gelöst/Komplexe?
Beurteilung der Wässer/Analysen: u.a. Laborfehler, Gesamtmineralisation, Ionenbilanz,
pH, pe, TW-Grenzwerte, wieviel Gips löst sich (delta-Wert in “Phase assemblage”) etc)
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
(Hinweis: Die wesentlichen PHREEQC-Keywords für das Input-File sind TITLE, SOLUTION,
END (auch zu finden im Keywords Index rechts).
Unter SOLUTION wird die chemische Zusammensetzung der Wasseranalyse definiert (die
Reihenfolge der Angaben gleichgültig).
Zu beachten ist dabei, dass
Einheiten (units) müssen definiert werden: Konzentration/Liter Lösung; Konzentration/kg
Lösung; Konzentration/kg Wasser (Konzentrationen in g oder mol)
abweichende Einheiten hinter dem entsprechendem Element z.B. Cd 2.5 µg/L
pH-Wert voreingestellt pH=7
Temperatur (temp) voreingestellt T=25°C
Dichte (density) kann angegeben werden (g/cm3); Voreinstellung 0.9998
Angabe des gemessenen EH-Wertes als umgerechneter pe-Wert (pE ≈ 16.9 * EH [EH in V])
Voreinstellung pe-Wert standartmäßig pe=4
Zusätzlich zum pe-Wert kann ein Redoxpaar (redox) definiert werden, um den Standart-peWert zu berechnen, der für weitere Berechnungen z.B. die Speziesverteilung redoxsensitiver
Elemente benutzt wird
Liste der analysierten Elemente, die nur in einer Redoxstufe auftreten
Elemente, deren Konzentrationen in verschiedenen Redoxstufen bestimmt wurden, werden mit
der Wertigkeit in Klammern angeben, z.B. Fe2+: Fe(2) 15.03
für Komplexe wie z.B für HCO3-, NO3-, SO42- gibt es drei Möglichkeiten der Eingabe:
[Ion]([Wertigkeit])[Konz. in mg/L] as [Komplexform] z.B. HCO3-: Alkalinity 58,52 as HCO3
[Ion]([Wertigkeit])[Konz. in mmol/L] gfw [Molmasse des Komplexes] (gfw = gram formular
weight) z.B. NO3-: N(5) 0.29 gfw 62.0
[Ion]([Wertigkeit])[Konz. in mmol/L] mmol/L abweichend von der unter units definierten
Einheit z.B. SO42-: S(6) 4.034 mmol/L (387,27 mg/L SO42-)
Wichtig ist bei der Definition von Einheiten, dass die Bezugsgröße (im Beispiel Liter) unter
units als auch hinter den betreffenden Elementen gleich ist; alternativ könnte man z.B. auch
unter units ppm definieren und hinter den einzelnen Elementen ppb oder mg/kgw (kg
Wasser) und mol/kgw hinzufügen
Zusätzlich hinter jedem Element, pH- oder pe-Wert der Befehl charge (nur einmal im
gesamten Input-File), erzwingt einen vollständigen Ladungsausgleich über das gewählte
Element, bzw. pH- oder pe-Wert (möglichst Element mit höchsten Konzentration)
Mineral- oder Gas-Phasenname mit Sättigungsindex hinter pH- oder pe-Wert oder einzelner
Elemente bewirkt Konzentrationsänderung des betreffenden Elements, um ein Gleichgwicht
oder definiertes Ungleichgewicht bezüglich der angegebenen Mineral- oder Gasphase zu
erreichen (Voreinstellung Sättigungsindex SI=0). Für Gase wird anstelle des Sättigungsindex
der Logarithmus des Partialdruckes in bar angegeben.
Redoxpaar separat hinter redoxsensitiven Elements definiert werden. Es wird eine
Redoxgleichgewichtsberechnung des redoxsensitiven Elements aus dem angegebenen
Redoxpaar erzwungen, d.h. der Standart-pe-Wert bzw. das Standart-Redoxpaar wird für dieses
Element nicht zur Berechnung Elementspezies verwendet.
Tastenkombination STRG+T: Liste der möglichen Spezies
Tastenkombination STRG+H: Liste der möglichen Phasen
Tastenkombination STRG+K: Liste der möglichen Minerale
über ENTER kann man sich die gewünschten Spezies, Phasen oder Minerale in das Input-File
holen.
beim Speichern des Input-File verwendet PHREEQC keine eigene Extension, deshalb
entweder eigene Extension .phrq anlegen oder alle Input-Files in einem separaten Verzeichnis
speichern (ASCII-Files).
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Aufgabe 2: Gleichgewichtsreaktion Gipslösung
Ein neuer Brunnen soll gebohrt werden. Aus logistischen Gründen (Länge der
Wasserrohrleitungen) soll dieser näher an der Stadt liegen. Der geplante neue Standort ist
unter Brunnen("B2") im Profilbild eingezeichnet.
Ist aus hydrogeochemischer Sicht dazu zu raten (Grenzwerte der TrinkwV 1990
berücksichtigen!)?
Gehen Sie bei Ihren Betrachtungen von einer generellen GW-Strömungsrichtung von Ost
nach West aus und betrachten Sie die Analyse des alten Brunnnens als „charakteristisch“ für
den Aquifer östlich des geplanten neuen Standpunktes. [Gleichgewichtsreaktion].
Zeigen Sie Veränderungen in der Wasserchemie auf und berücksichtigen Sie bei einer
abschließenden Bewertung auch die Grenzwerte der deutschen Trinkwasserverordnung
(Novellierung vom 21. Mai 2001).
Laden Sie dazu die Wasseranalyse von Aufgabe 1 in ihr Input-File. Speichern Sie dann das
File als Aufg_2.phrq ab. Unter dem Keyword EQUILIBRIUM_PHASES geben Sie nun die
Gleichgewichtsreaktion mit Gips an. Starten Sie nun die Berechnung indem Sie auf Calculate
klicken.
Hinweis: über das PHREEQC keyword EQUILIBRIUM_PHASES kann man nicht nur
Gleichgewichte (Voreinstellung ist SI = 0), sondern auch definierte Ungleichgewichte über
den Sättigungsindex angeben, z.B. 20%ige Sättigung SI = log 0.2 ≈ -0.7; eine 80%ige
Sättigung (Untersättigung), würde bedeuten: IAP/KT = 80 % = 0.8; log IAP/KT = SI = log
0.8 ≈ -0.1
SI = log (IAP/LP)
Als Sättigungsindex wird der dekadische Logarithmus des Quontienten aus
Ionenaktivitätsprodukt (IAP) und Löslichkeitsprodukt (LP) bezeichnet. Das IAP berechnet
sich dabei aus den analytisch bestimmten Konzentrationen einer gegebenen Wasseranalyse
durch Umrechnung in Aktivitäten unter Berücksichtigung der Ionenstärke, der Temperatur
des Wassers sowie der Komplexbildung. Das LP ergibt sich aus der maximal möglichen
Löslichkeit (Datensatz- oder Literatur-Wert) durch Umrechnung auf die Wassertemperatur.
Der Sättigungsindex gibt an, ob eine Lösung im Gleichgewicht mit einer festen Phase oder
unter- bzw übersättigt in Bezug auf diese feste Phase ist.
Hierbei bedeutet ein Wert von z.B. +1 eine 10fache Übersättigung, ein Wert von -2 eine
100fache Untersättigung bezüglich einer bestimmten Mineralphase. In der Praxis kann
angenommen werden, dass im Bereich von -0.2 bis +0.2 von einem quasi-Gleichgewicht
gesprochen werden kann; ist der berechnete SI kleiner als -0.2 kann somit von Untersättigung
bezüglich der jeweiligen Mineralphase gesprochen werden, ist er größer als +0.2 von
Übersättigung.
im Beispiel:
TITLE Aufgabe 2: Gleichgewichtsreakion Gipslösung
SOLUTION 1
…
EQUILIBRIUM_PHASES 1
Gypsum 0
#Voreinstellung SI = 0; muss nicht zwingend geschrieben werden
END
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Hinweis Output-File:
Klicken Sie im Output-File unter Simulation 1 – Beginning of batch-reaction calculation Reaction Step 1 – Phase assemblage an.
Darunter wird angegeben: Mineralphase – SI – log IAP – log KT – initial (anfängliche
Menge an Gips, standardmäßig auf 10 mol/kg eingestellt) – final (Menge an Gips, die nach
dem Lösungsprozess noch ungelöst vorliegt) – delta (Menge an gelöstem Gips = final-initial;
negativer Wert = Lösung; positiver Wert = Fällung).
im Beispiel:
Delta Gypsum = - 1.432e-02 mol/L, d.h. durch den Kontakt mit dieser Lagerstätte
(EQUILIBRIUM_PHASES gypsum 0) können sich im Grundwasser noch -1.432e-02 mol/L
Gips ( 1.948 g/L, Molmasse CaSO4: 136 g/mol) lösen
Aufgabe 3: Ungleichgewichtsreaktion Gipslösung
Wie ändert sich die Wasserqualität, wenn man davon ausgeht, daß die Verweilzeiten im
Untergrund so gering sind, dass nur eine 50%ige Sättigung mit der vorherrschenden
Mineralphase im Untergrund eintreten wird?
Laden Sie dazu die Wasseranalyse von Aufgabe 1 in ihr Input-File. Speichern Sie dann das
File als Aufg_3.phrq ab. Unter dem Keyword EQUILIBRIUM_PHASES geben Sie nun die
Ungleichgewichtsreaktion mit Gips an. Starten Sie nun die Berechnung indem Sie auf
Calculate klicken.
im Beispiel:
TITLE Aufgabe 3: Ungleichgewichtsreaktion Gipslösung
SOLUTION 1
…
EQUILIBRIUM_PHASES 1
Gypsum -0.3 # bei 50%iger Sättigung SI = log 0.5 = -0.3
END
Hinweis Output-File:
Klicken Sie im Output-File unter Simulation 1 – Beginning of batch-reaction calculation Reaction Step 1 – Phase assemblage an.
Darunter wird angegeben: Mineralphase – SI – log IAP – log KT – initial (anfängliche
Menge an Gips, standardmäßig auf 10 mol/kg eingestellt) – final (Menge an Gips, die nach
dem Lösungsprozess noch ungelöst vorliegt) – delta (Menge an gelöstem Gips = final-initial;
negativer Wert = Lösung; positiver Wert = Fällung).
im Beispiel:
Delta Gypsum = -7.832e-03 mol/L, d.h. durch den Kontakt mit dieser Lagerstätte
(EQUILIBRIUM_PHASES gypsum -0.3) können sich im Grundwasser noch -7.832e-03 mol/L
Gips ( 1.065 g/L, Molmasse CaSO4: 136 g/mol) lösen
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Aufgabe 4: Temperaturabhängigkeit der Gipslösung in Brunnenwasser
Neuere Bohrungen in der Nähe lassen einen gewissen geothermalen Einfluss in dieser
Umgebung erwarten. Wie würden sich unterschiedliche Temperaturen im Untergrund auf die
Wasserbeschaffenheit und die zu erwartende Trinkwasserqualität im neuen Brunnen B2
auswirken.
Simulieren Sie Ihre Brunnenanalyse für Temperaturen von 10, 20, 30, 40, 50, 60, 70 °C.
Beachten Sie, dass aufgrund der kurzen Verweilzeit nur eine 50%ige Sättigung mit der
vorherrschenden Mineralphase im Untergrund dabei eintreten wird.
a)
b)
c)
Bei welcher Temperatur liegt das Maximum der Gipslöslichkeit?
Stellen Sie die den Kurvenverlauf der Gipslöslichkeit im Diagramm dar.
Neben der Gipslöslichkeit kommt es zur Komplexbildung verschiedener Ca-Komplexe.
o Welche sind das?
o In welchen Konzentrationen (mmol/L) liegen sie vor?
o Stellen Sie die Speziesverteilung für diese Ca-Komplexe graphisch dar.
Ablauf:
Für das Maximum der Gipslöslichkeit lassen Sie sich nun unter SELECTED_OUTPUT den
Sättigungsindex und den tatsächlichen Verbrauch an Gips ausgeben oder klicken Sie im
Output-File unter den entsprechenden Reaction Step # – Phase assemblage an.
Die Ca-Komplexe, die sich bei der entsprechenden Reaktionstemperatur bilden oder auflösen
finden Sie mit den dazugehörigen Molalitäten unter den entsprechenden Reaction Step # –
Distribution of species - oder definieren Sie sich unter SELECTED_OUTPUT mit dem
dazugehörigen Keyword -molalities
Hinweis:
Enthalpie:
Gibt den Energieinhalt eines Stoffes in Abhängigkeit von seiner Temperatur und Masse an.
Die Differenz zwischen den unterschiedlichen Enthalpien eines Stoffes bei verschiedenen
Temperaturen gibt die maximal gewinnbare Energie oder die minimal aufzuwendende
Energie für die Änderung an. Die Enthalpie wird angegeben in Joule. Die Enthalpiedifferenz
in Joule pro Kilogramm.
In der Chemie wird die frei werdende oder benötigte Wärmeenergie als Reaktionswärme
(oder als Reaktionsenthalpie) bezeichnet.
Die Reaktionswärme ist die Differenz der Summen aller Bildungswärmen der Ausgangs- und
der Endstoffe:
Bei exothermen Reaktionen ergibt sich für die Reaktionswärme HR aufgrund der Formel ein
Wert kleiner als 0 (Energie wird freigesetzt), bei endothermen Reaktionen größer als 0
(Energie wird benötigt). Die Bildungswärme ist ein ungefähres Maß für die Stabilität einer
chemischen Verbindung. Je mehr Wärmeenergie bei der Bildung einer Verbindung freigesetzt
wird, desto stabiler ist sie.
Die Entropie ist temperaturabhängig:
Mit steigender Temperatur nimmt die Unordnung der Stoffe zu. Für Stoffe wird die Entropie
(So) bei Standardbedingungen angegeben. Bei jeder chemischen Reaktion ändert sich der
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Ordnungszustand des Stoffsystems und damit auch die Entropie. Die molare
Reaktionsentropie SR ergibt sich aus der Differenz der Entropien der Reaktionsprodukte und
den Entropien der Ausgangsstoffe:
Bei positiven Werten von S nimmt die Unordnung des Systems zu, bei negativen Werten
nimmt die Entropie bei der Reaktion ab.
Hinweis: über das PHREEQC keyword REACTION_TEMPERATURE können
Reaktionstemperaturen oder Temperaturschritte angegeben werden. Dabei werden die
Temperaturen hintereinander, lediglich durch Leerzeichen getrennt, geschrieben oder der
Beginn und Ende Simulationsbereiches sowie die Schrittanzahl werden angegeben
im Beispiel:
…
REACTION_TEMPERATURE
10 20 30 40 50 60 70
# oder 10 70 in 7 steps
END
Hinweis: Es ist möglich, Daten im Spreadsheet-Format darzustellen. Dazu muss im Input-File
über den Befehl SELECTED_OUTPUT explizit angegeben werden, was ausgegeben werden
soll, so z.B. Sättigungsindizies, Element- oder Spezieskonzentrationen etc. Nachstehend einige
PHREEQC-Befehle (fettgedruckt); beendet wird der Ausgabe-Ausdruck mit END:
SELECTED_OUTPUT
-file
file name.csv
-reset
false
-step
false/true
-solution
false/true
# Ausgabe in dieses File
# kein Standart-Output drucken
# default; Reaktionsschritt für Batchreaktion-Simulation
# default; Ausgabe Solutionnummer für Simulation in
jeder Zeile des Selected_Output-Files
-state
false/true
# default; Ausgabe Typ für Simulation in jeder Zeile des
Selected_Output-Files
-ph
false/true
# default
-pe
false/true
# default
-temperature false/true
# default
-totals
Ca S(6) Fe
# Gesamtkonzentrationen der Elemente (mol/L)
-molalities Fe+2 SO4-2 FeCO3 # Spezieskonzentrationen
-equilibrium_phases gypsum
# Gleich-/Ungleichgewichtseinstellung (mol/L)
-saturation_indices Calcite
# Sättigungsindizes
-reaction
Calcite
# Ausgabe der Zugabemenge(n) des Reaktanten
END
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
im Beispiel:
…
SELECTED_OUTPUT
-file Aufg_4.csv
# Ausgabe in dieses File
-reset false
# kein Standard-Output drucken
-step
# Reaktionsschritt für Batchreaktion-Simulation
-temperature
#Temperaturschritte
-totals Ca S(6)
# Gesamtkonzentrationen der Element Calcium und Sulfat (mol/L)
-molalities Ca+2 CaSO4 CaHCO3+ CaCO3 # Spezieskonzentrationen (mol/L)
-equilibrium_phases gypsum
# Gleich-/Ungleichgewichtseinstellung (mol/L)
END
Aufgabe 5 (Zusatz): Temperaturabhängigkeit der Gipslösung in destilliertem Wasser
Nur zum Vergleich: welche Mengen an Gips lösen sich unter den gleichen Temperaturen in
destilliertem Wasser und wie erklärt sich der Unterschied im Vergleich zum Brunnenwasser?
a)
b)
Stellen Sie die die Kurvenverläufe der Gipslöslichkeit für das Brunnenwasser und das
destillierte Wasser graphisch in einem Diagramm dar.
Wo kann sich mehr Gips lösen?
im Beispiel:
…
SELECTED_OUTPUT
-file Aufg_5.csv
# Ausgabe in dieses File
-reset false
# kein Standard-Output drucken
-step
# Reaktionsschritt für Batchreaktion-Simulation
-temperature
#Temperaturschritte
-totals Ca S(6)
# Gesamtkonzentrationen der Element Calcium und Sulfat (mol/L)
-molalities Ca+2 CaSO4 CaHCO3+ CaCO3 # Spezieskonzentrationen (mol/L)
-equilibrium_phases gypsum
# Gleich-/Ungleichgewichtseinstellung (mol/L)
END
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Aufgabe 6: Calcitlösung in Abhängigkeit von Temperatur und CO2-Partialdruck
Im alten Brunnen (B3), der nach wie vor zur Trinkwassergewinnung genutzt werden soll,
wurden jahreszeitlich schwankende Ca-Gehalte gemessen. Dieses Phänomen ist auf die
Karstverwitterung zurückzuführen, die neben der Temperatur auch vom CO2-Partialdruck im
Boden abhängig ist (das CO2 im Boden entsteht durch mikrobielle Abbaureaktionen).
Simulieren Sie die theoretische Löslichkeit des Calcits über das Jahr verteilt bei Temperaturen
an Wintertagen von 0 °C und einem CO2-Partialdruck, der lediglich dem der Atmosphäre
entspricht und ohne zusätzliche Bioproduktion (p(CO2) = 0.03 Vol%) bis hin zu heißen
Sommertagen mit Temperaturen von 40 °C und hoher Bioproduktion (p(CO2) = 10 Vol%).
Verwenden Sie REACTION_TEMPERATURE um Temperaturen zwischen 0 und 40 °C in
Abständen von 5 °C zu modellieren und variieren Sie den CO2-Partialdruck wie folgt:
CO2 (Vol%)
0.03
0.5
0.9
2
4.5
7
10
d.h. für jeden CO2-Partialdruck geben Sie im Input-File die Reaktionstemperaturen von 0 bis
40 °C an.
a)
b)
c)
d)
e)
Von was ist die Calcitlösung abhängig und warum?
Stellen Sie die Ergebnisse graphisch dar.
Welche Kombinationen aus Temperatur und CO2-Partialdruck sind logisch (wenig
Bioproduktivität bei Kälte, hohe Bioproduktivität bei Wärme, aber auch schlechtere
Lösung von CO2 in Wasser bei erhöhter Temperatur!) und
wie sähe danach eine mögliche „reale“ Calcit-Lösung aus? (Optimumkurve händisch in
Grafik einbauen!)
Wo liegt das Maximum der Karstverwitterung (tabellarisch und grafisch Darstellung)
und warum?
Hinweis:
Abhängigkeit des Löslichkeitsprodukts vom Partialdruck
Erhöhte Lösung und Fällung von Mineralen in der obersten Bodenschicht liegt vor allem am
höheren CO2-Partialdruck im Boden (in der Vegetationszeit durch biologische und
mikrobiologische Aktivität ca. 10-100 mal größer als in der Atmosphäre). Durchschnittliche
CO2-Partialdrücke betragen unter humiden Klimabedingungen im Sommer ca. 3 bis 5 kPa
(=3-5 Vol%), unter tropischen Bedingungen mit erhöhter Bioaktivität bis über 30 Vol% und
im Bereich von Deponien oder organischen Kontaminationen bis zu 60 Vol%. Da bei
erhöhtem CO2-Partialdruck auch die Protonenaktivität im Wasser erhöht ist, kommt es zu
einer bevorzugten Lösung von Mineralen, deren Löslichkeit pH-abhängig ist.
Hinweis: über das PHREEQC keyword EQUILIBRIUM_PHASES kann man auch
Gleichgewichte/Ungleichgewichte für Gase (offenes System!) angeben. Dabei wird anstelle
des Sättigungsindex der Logarithmus des Partialdruckes in bar angegeben.
im Beispiel:
…
EQUILIBRIUM_PHASES
CO2(g) -3.52
# CO2-Partialdruck (Vol%) 0.03 = 3e-4 bar, log 3e-4 = -3.52
Calcite 0
# 100%ige Sättigung SI = log 1 ≈ 0
…
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Hinweis:
Es können beliebig viele Simulationen hintereinander in dasselbe Input-File geschrieben
werden, es ist lediglich zu beachten, das die einzelnen Simulations-Anweisungen
durchnummeriert und mit END abgeschlossen werden, z.B.
SOLUTION 1
…
# CO2-Partialdruck (Vol%) 0.03
END
SOLUTION 2
…
# CO2-Partialdruck (Vol%) 0.5
END
usw.
Ablauf:
Laden Sie dazu die Brunnenanalyse in ihr Input-File. Speichern Sie dann das File als
Aufg_6.phrq ab. Unter dem Keyword EQUILIBRIUM_PHASES geben Sie nun den
entsprechenden CO2-Partialdruck und die Calcite Phase an. Unter dem Keyword
REACTION_TEMPERATURE die Reaktionstemperaturen, wahlweise einzeln aufgelistet
oder den Temperaturbeginn, Temperaturende und die Schrittanzahl (siehe dazu auch Hinweis
Aufgabe 4).
Für jeden Partialdruck müssen Sie ein eigenes PhreeqC-Input-File erstellen und abspeichern
oder Sie nummerieren Ihre SOLUTION entsprechend durch (siehe dazu obigen Hinweis.
Lassen Sie sich im Output (SELECTED-OUTPUT) die Reaktionstemperaturen, die
Gesamtkonzentration an Calcite sowie die Gleich-/Ungleichgewichtseinstellung bezüglich der
Calcite Phase ausgeben (siehe dazu auch Hinweis Aufgabe 4). Beachten Sie, dass Sie für
jedes SELECTED-OUTPUT-File einen eigenen Dateinamen angeben.
Im Beispiel:
TITLE Aufgabe 6: Calcitlösung in Abhängigkeit von Temperatur und CO2-Partialdruck
SOLUTION 1
# CO2-Partialdruck (Vol%) 0.03
…
EQUILIBRIUM_PHASES
CO2(g) -3.52
# CO2-Partialdruck (Vol%) 0.03 = 3e-4 bar, log 3e-4 = -3.52
Calcite 0
REACTION_TEMPERATURE
0 5 10 15 20 25 30 35 40 # wahlweise auch schreiben: 0 40 in 9 steps
SELECTED_OUTPUT
-file Aufg_6_003Vol.csv
-reset false
-step
-temperature
-equilibrium_phases calcite
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
-totals Ca
END
SOLUTION 2
…
# CO2-Partialdruck (Vol%) 0.5
EQUILIBRIUM_PHASES
CO2(g) -2.30
# CO2-Partialdruck (Vol%) 0.5 = 5e-3 bar, log 5e-3 = -2.30
Calcite 0
REACTION_TEMPERATURE
0 5 10 15 20 25 30 35 40
# wahlweise auch schreiben: 0 40 in 9 steps
SELECTED_OUTPUT
-file Aufg_6_05Vol.csv
-reset false
-step
-temperature
-equilibrium_phases calcite
-totals Ca
END
usw.
Aufgabe 7: Calcit- und Dolomitlösung
Was passiert, wenn nicht nur reines Calcium-Carbonat (Calcit) sondern daneben auch
Magnesium-Calcium-Carbonat (Dolomit) vorliegt?
Verwenden Sie hierbei die folgende vorgegebene Kombination von möglichen Temperaturen
und CO2-Werten:
Temp. °C
CO2 (Vol%)
a)
b)
c)
d)
e)
0
0.03
5
0.5
8
0.9
15
2
25
4.5
30
7
40
10
Stellen Sie die Ergebnisse graphisch dar
Wie nennt man diese Art der Reaktion?
Wo liegt das Maximum der Calcitfällung bei Dolomitanwesenheit?
Wo liegt das Maximum der Dolomitlösung bei Calcitanwesenheit?
Wo liegt das Maximum der Calcitfällung bei Dolomitabwesenheit?
Hinweis:
Als Inkongruente Lösungen
werden Lösungen bezeichnet, bei denen ein Mineral gelöst wird, während ein anderes
zwangsläufig ausfällt. Kommt z.B. ein Wasser, das im Gleichgewicht mit Calcit (SI=0) ist,
mit Dolomit in Kontakt, wird so lange Dolomit gelöst bis sich auch ein Gleichgewicht
bezüglich des Dolomits eingestellt hat. Hierdurch werden die Konzentrationen von Ca, Mg, C
im Wasser erhöht, was zwangsläufig dazu führt, dass das Wasser hinsichtlich des Calcits
übersättigt wird und somit der Calcit ausfällt.
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Ablauf:
Laden Sie dazu die Brunnenanalyse in ihr Input-File. Speichern Sie dann das File als
Aufg_7.phrq ab. Geben Sie unter SOLUTION die entsprechende Temperatur an.
Unter dem Keyword EQUILIBRIUM_PHASES geben Sie nun den entsprechenden CO2Partialdruck, die Calcite Phase und Dolomite Phase an.
Nummerieren Sie Ihre SOLUTIONs im Input-File entsprechend durch.
Berücksichtigen Sie, dass Sie einmal die Simulation bei gleichzeitiger Anwesenheit von
Calcite und Dolomite durchlaufen lassen und einmal nur mit Calcite.
Lassen Sie sich im Output-file (SELECTED-OUTPUT) die entsprechende
Reaktionstemperatur und die Gleich-/Ungleichgewichtseinstellung bezüglich der Calcite und
Dolomite Phase ausgeben.
Zusätzlich können Sie sich für alle Simulationen die Ergebnisse auch nur in einem csv-File
ausgeben lassen. Dazu muss das keyword SELECTED-OUTPUT in der ersten Simulation
stehen noch vor END der SOLUTION 1.
Im Beispiel:
TITLE Aufgabe 7: Calcit- und Dolomitlösung
# Solution 1 bis 7 bei gleichzeitiger Anwesenheit von Calcit und Dolomit;
#Solution 8 bis 14 nur mit Calcit
SOLUTION 1
# CO2-Partialdruck (Vol%) 0.03
…
temp
0
# Temperaturvorgabe 0 °C
…
EQUILIBRIUM_PHASES
CO2(g) -3.5
# CO2-Partialdruck (Vol%) 0.03 = 3e-4 bar, log 3e-4 = -3.52
Calcite 0
dolomite(d) 0
SELECTED_OUTPUT
-file Aufg_7_003Vol.csv
-reset false
-step
-temperature
-equilibrium_phases Calcite dolomite(d)
END
SOLUTION 2
# CO2-Partialdruck (Vol%) 0.5
…
temp
5
# Temperaturvorgabe 5 °C
…
EQUILIBRIUM_PHASES
CO2(g) -2.3
# CO2-Partialdruck (Vol%) 0.5 = 5e-3 bar, log 5e-3 = -2.3
Calcite 0
dolomite(d) 0
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
SELECTED_OUTPUT
-file Aufg_7_05Vol.csv
-reset false
-step
-temperature
-equilibrium_phases Calcite dolomite(d)
END
usw.
Aufgabe 8: Vergleich Calcitlösungen im offenen und geschlossenen System:
Bei den Simulationen Aufgabe 6+7 sind Sie davon ausgegangen, dass CO2 in beliebiger
Menge vorhanden ist. Solche Systeme nennt man „offene Systeme“. Real ist dies oft nicht der
Fall und es steht nur eine begrenzte Menge Gas zur Verfügung (geschlossenes System).
Simulieren Sie für den Brunnen die Calcit-Lösung im Vergleich in einem offenen und einem
geschlossenen System bei einer Temperatur von 15°C und einem Partialdruck von 2 bzw. 20
Vol%.
a)
b)
c)
d)
Wo löst sich mehr Calcit im Wasser, im offenen oder geschlossenen System?
Welchen CO2-Partialdruck weist das Wasser der Brunnenanalyse vor der
Gleichgewichtsreaktion mit Calcite bereits auf?
Was ändert sich mit steigendem Partialdruck und warum?
Vergleichen Sie das offenes/geschlossenes System bei dem entsprechenden
Partialdrücken.
Hinweis: über das PHREEQC keyword GAS_PHASE werden Gaspartialdrücke für
geschlossene Systeme definiert mit dem Gesamtdruck in bar (Vorgabe: 1 bar), dem
Gasvolumen in L Gas pro L Wasser (Vorgabe: 1LGas/1LWasser) und die Temperatur des
Gases in °C (Vorgabe: 35°C). Zusätzlich muss die Angabe erfolgen, um welches Gas es sich
handelt und mit welchem Partialdruck es vorliegt.
Der Partialdruck wird für geschlossene Systeme in bar, und nicht wie in offenen Systemen
(EQUILIBRIUM_PHASES) als log p(CO2) angegeben.
im Beispiel:
…
GAS_PHASE
-fixed_pressure
-pressure
1
-volume
1
-temperature 35
CO2(g) 0.02
# für geschlossenes System zu verwenden
# Gesamtdruck mit 1 bar
# Volume mit 1L Gas pro L Wasser
# Temperatur des Gases von 35 °C
# verwendet wird hier das Gas CO2 mit einem CO2-Partialdruck 2Vol%
= 0.02 bar (hier in bar anzugeben!)
END
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01
Seminar Hydrogeochemische Modellierung mit PHREEQC - WS 2008/2009
Ablauf:
Laden Sie dazu die Brunnenanalyse in ihr Input-File. Speichern Sie dann das File als
Aufg_8.phrq ab. Ändern Sie in der jeweiligen SOLUTION die Temperatur auf 15 °C.
Geben Sie bei dem geschlossenem System unter dem Keyword EQUILIBRIUM_PHASES
die Gleichgewichtsreaktion mit Calcite an, sowie unter dem Keyword GAS_PHASE den
Gaspartialdruck für CO2 in bar an sowie die weiteren Angaben zum Gesamtdruck, Volumen
und Temperatur des Gases.
Im offenen System geben Sie unter EQUILIBRIUM_PHASES die Gleichgewichtsreaktion
mit Calcite sowie die Reaktion mit CO2 für den entsprechenden Gaspartialdruck an (Achtung:
hier die Angabe des log p(CO2)).
Lassen Sie sich unter dem Keyword SELECTED-OUTPUT die Angaben zum pH-Wert und
delta_Calcite bei den entsprechenen CO2-Partialdrücken sowohl für das geschlossene als auch
das offene System ausgeben, sowie den entsprechenden SI für CO2.
Nützliche Websites:
USGS PHREEQC-2 website:
http://wwwbrr.cr.usgs.gov/projects/GWC_coupled/phreeqc/index.html
PHREEQC-2 for WINDOWS (Download Version 2.13.04, January 31st, 2007):
http://www.geo.vu.nl/users/posv/phreeqc/index.html
Manual zu PHREEQC-2 (.pdf):
http://www.geo.tu-freiberg.de/hydro/vorl_portal/phreeqc/manual.pdf
Bücher:
Merkel, B. J. & Planer-Friedrich, B. (2002): Grundwasserchemie - praxisorientierter
Leitfaden zur numerischen Modellierung von Beschaffenheit, Kontamination und Sanierung
aquatischer Systeme. – 219 S., 76 Abb., inkl. CD-ROM; Berlin, Heidelberg (Springer; ISBN
3-540-42836-4).
Merkel, B. J., Planer-Friedrich, B., Nordstrom, D.K. (2005): Groundwater Geochemistry - A
Practical Guide to Modeling of Natural and Contaminated Aquatic Systems. - 200 p., 76 illus.,
with CD-ROM; Berlin, Heidelberg (Springer; ISBN 978-3-540-24195-9).
Prof. Merkel / Dipl.-Geoökol. Schipek / Dipl.-Geol. Gezahegne - TU Bergakademie Freiberg/Aufgabenblock_01